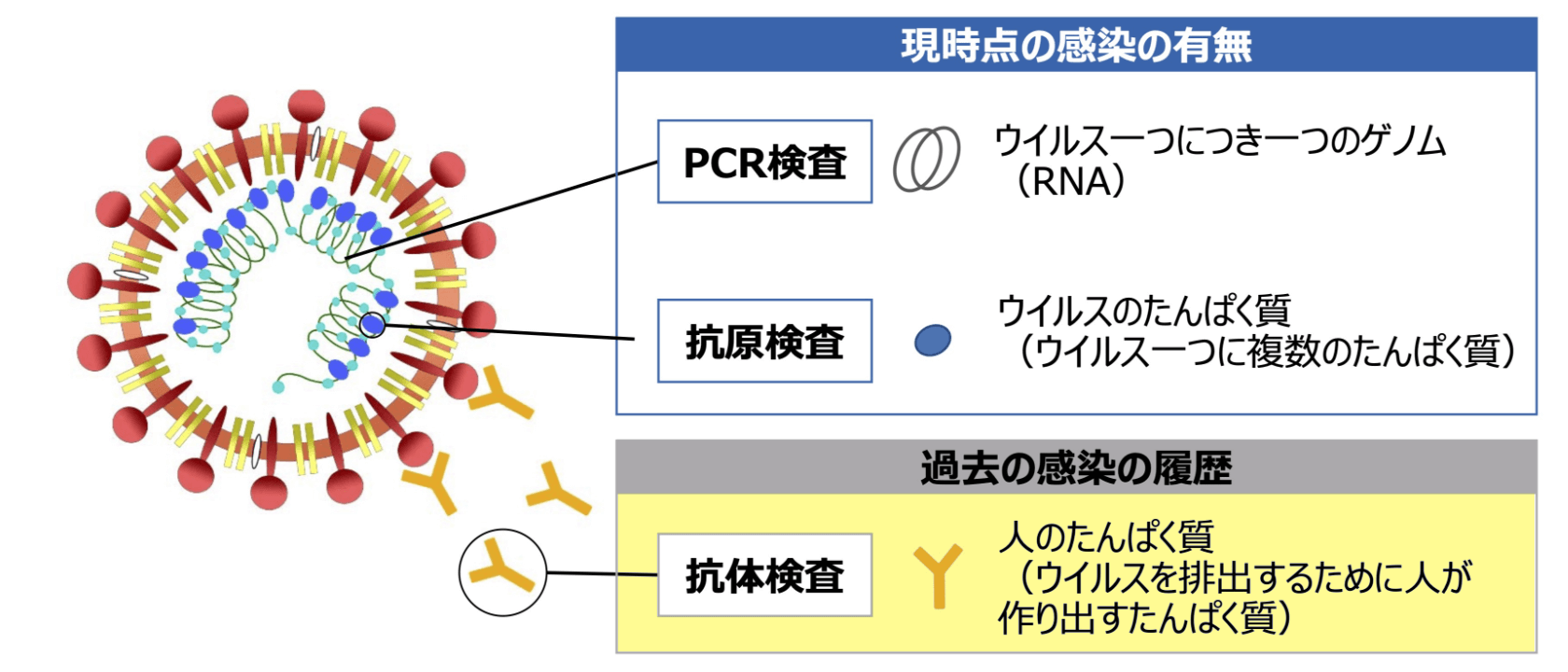
新型コロナウイルス感染症
(COVID-19)の検査
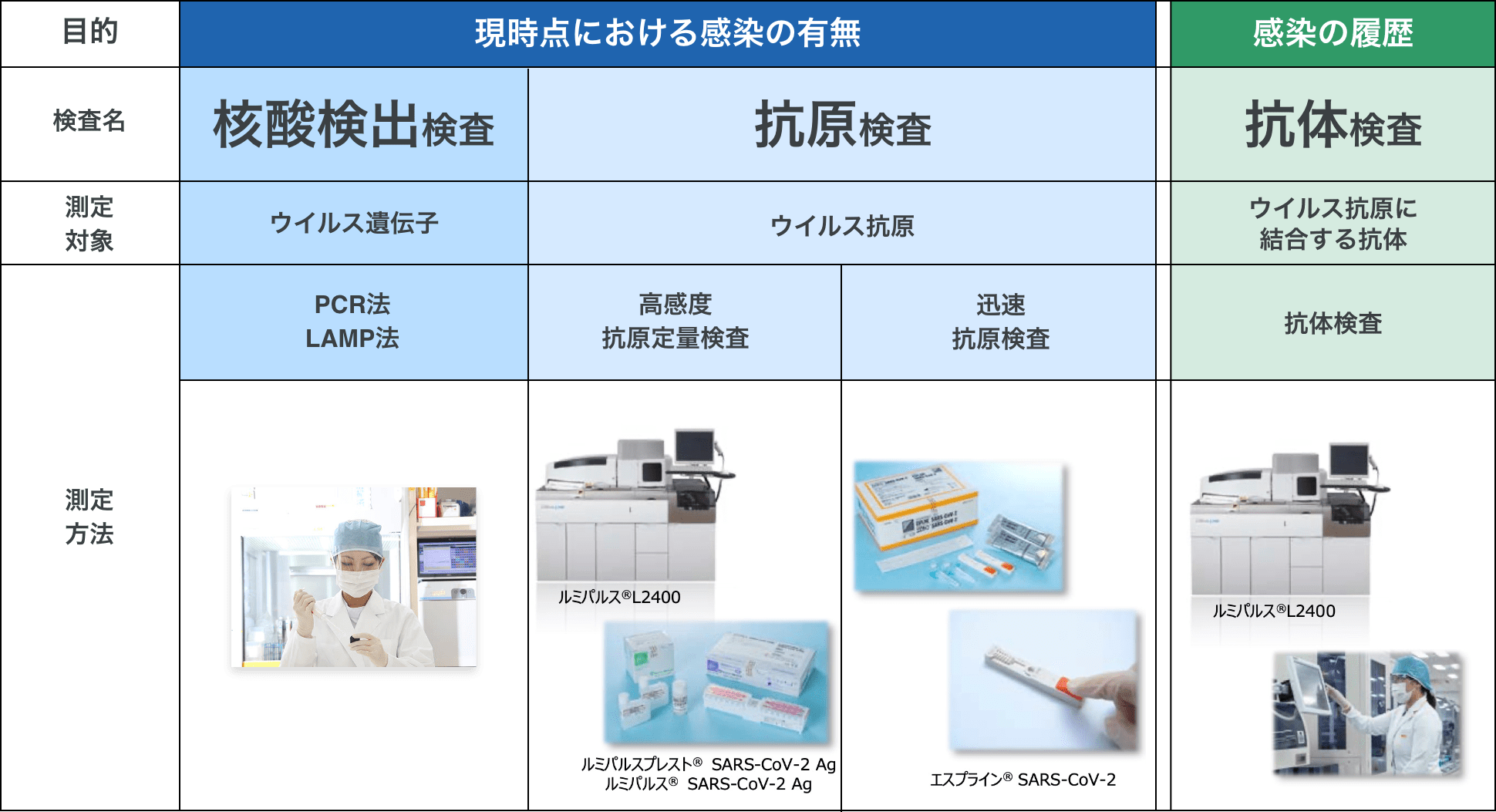
COVID-19検査の種類と特徴
COVID-19に関連する検査には、大別して核酸検出検査・抗原検査・抗体検査の3つがあります。ここではそれぞれの検査の違いや特徴、メリット、デメリットを紹介します。
検査の種類と違い

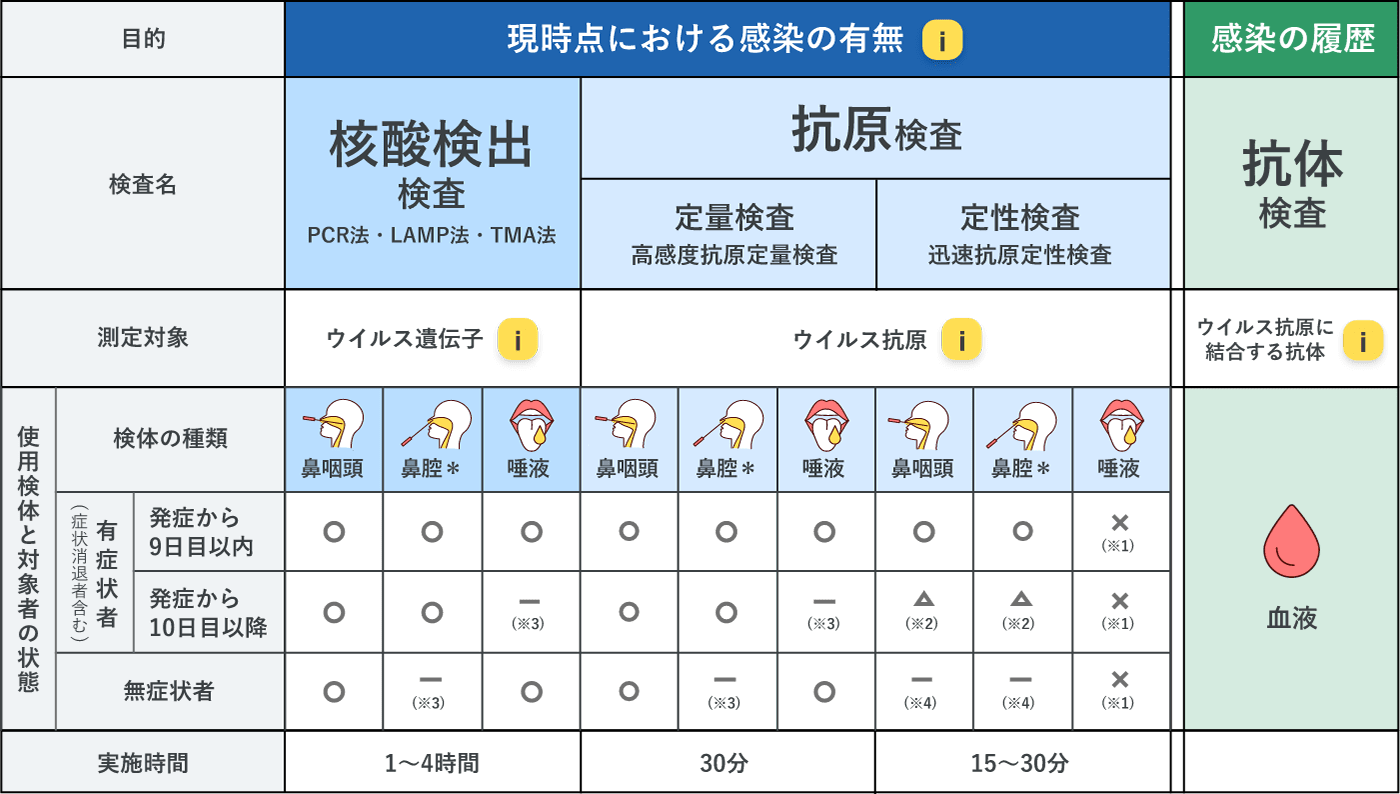
使用検体と対象者の状態:厚生労働省ほか. 新型コロナウイルス感染症(COVID-19)病原体検査の指針 第4版より
※1:有症状者への使用は研究中。無症状者への使用は研究を予定している。(×)
※2:使用可能だが、陰性の場合は臨床像から必要に応じて核酸検出検査や抗原定量検査を行うことが推奨される。(△)
※3:推奨されない。(-)
※4:確定診断としての使用は推奨されないが、感染拡大地域の医療機関や高齢者施設等において幅広く検査を実施する際にスクリーニングに使用することは可能。ただし、結果が陰性の場合でも感染予防策を継続すること、また、結果が陽性の場合であって医師が必要と認めれば核酸検出検査や抗原定量検査により確認すること。
*:引き続き検討が必要であるものの、有用な検体である。
一般に広く用いられている「核酸検出検査」では、PCR法などを用いて
新型コロナウイルス(SARS-CoV-2)のRNAを測定
ウイルスのRNAを測定することでSARS-CoV-2を検出する方法です。 一般的にウイルスのRNAを増幅するpolymerase chain reaction(PCR)が用いられます。PCR法とは原理が異なりますが、ウイルスのRNAを増幅して判定する方法として、簡便かつ短時間で結果判定可能な手法としてloop-mediated isothermal amplification(LAMP)や transcription mediated amplification(TMA)などがあります。使用する検体として、鼻咽頭ぬぐい液、鼻腔ぬぐい液または唾液等を用います。
■ PCR検査の特徴
- ウイルス量が少なくても検出できるため、有症状者、無症状者を問わず利用可能
-
試薬・手法により、性能が大きく異なるため、 使用するシーンや環境等に応じて、適切な試薬を選択する必要がある1,2)
- 感染能を有していないと考えられる分離培養ができない検体も陽性と判定してしまう可能性があり、臨床的な他の所見等を加味して臨床的判断が必要
- ウイルスのRNAを増幅して測定するため、コンタミネーション(他の検体の増幅物による影響により偽陽性となる可能性がある)および阻害物質のリスクがあり、精度管理が重要
1) MacKay MJ, et al. Nat Biotechnol. 2020; 38: 1021–1024.
2) 宮地 勇人. 厚生労働省委託事業「新型コロナウイルス感染症のPCR 検査等にかかる精度管理調査業務」報告書 https://www.mhlw.go.jp/content/000769978.pdf.
Accessed June 28, 2021.
短時間で結果が出る「抗原検査」は、高感度、迅速の2種類がある
ウイルス抗原を測定することでSARS-CoV-2を検出する方法です。高感度な抗原定量検査と、簡便かつ迅速な抗原定性検査があります。
抗原定性検査は、臨床現場即時検査(POCT)として使用可能です。抗原定性検査は、現状では唾液は利用できず、鼻腔や鼻咽頭のぬぐい液で検査を行います。鼻腔ぬぐい液は、医療従事者の管理下で患者さん自身が検体を採取することが可能ですが、医療従事者の常駐しない施設等で抗原定性検査を迅速に実施する場合には、検体採取の注意点を理解した職員の管理下で実施することも可能です。H.U.グループの抗原定量検査試薬、ルミパルス
SARS-CoV-2 Agでは、患者さん自身で採取可能な唾液が利用できます。
■ 抗原定量検査の特徴
- ウイルス量が少なくても検出できるため、有症状者、無症状者を問わず、スクリーニングが可能
- 30分程度と短時間で結果が判明
- 簡易な核酸検出検査と同レベルの検出精度を有し、確定診断に用いることが可能
- 専用機器を用いることにより、全自動・大量処理が可能
- 一般の検査室で長年利用されている専用機の利用が可能
- 非特異的な反応などを理由とする再検査が必要となるケースがある。その場合には遠心分離後に上清を採取して再検査、または核酸検出検査などを実施する
■ 抗原定性検査の特徴
- ウイルス量が一定以上でないと偽陰性(感染しているのに陰性と判定される)になる可能性あり
- 15~30分程度と短時間で結果が判明
- 特別な検査機器が不要なものが多く、その場で結果が確認可能
- 感染拡大地域など幅広く検査が必要な場合に有効
- 周囲に感染を広げるリスクがある人は、十分なウイルス量を有するため、検出可能
- 無症状者の確定診断として用いることは推奨されないが、迅速な対応が求められる場合には、使用も可能。ただしその場合には、結果の信頼性が低いことを鑑み、核酸検出検査等を利用した追試を実施する

SARS-CoV-2感染歴の指標になり得る「抗体検査」
血液中の抗体を調べることで、過去のSARS-CoV-2感染歴を確認することが可能な方法です。抗体検査では、感染後1~3週間以降に陽性となることが知られており、抗体検査で陽性となっても、その時点での感染の有無は判定できないことに注意が必要です。検査目的に応じた各種ウイルスたんぱく質に対する抗体の検査が可能であり、抗体の種類、抗体の標的によって使い分けが可能です。
■ 抗体検査の特徴
- 検査には血液検体を用いる
- SARS-CoV-2感染歴を確認可能
- 感染後1~3週間経過しないと検出できない(現在のSARS-CoV-2ウイルス感染の有無は判定できない)
- IgMは感染後約1~2週間程度で上昇することが期待され、その後、減少する
- IgGは感染後IgMとほぼ同時期に上昇することが期待され、その後は一定期間保持される
- ワクチン接種後数週間で検査値(SARS-Cov-2に対する抗体量)が上昇することが期待される
-
ヌクレオカプシドたんぱく質に対する抗体は、現在国内で承認されているSARS-CoV-2ワクチンでは上昇が期待できない注)
- スパイクたんぱく質に対する抗体は現在国内で承認されているワクチンを接種後に上昇することが予想され、感染歴との区別がつかなくなる
-
日本では承認試薬はなく、研究用に使用可能注)
注)2021年8月1日現在
<参考> 抗体検査に使用可能な抗体の種類とその特徴
| 抗体の種類 | 特徴 |
|---|---|
| SARS-CoV-2のスパイク(S)たんぱく質を標的とするIgG抗体 | SARS-CoV-2に対する適応免疫反応を示す個人を識別するために補助的に使用でき、最近または過去の感染の有無を評価可能です。現在国内で承認されているSARS-CoV-2ワクチンによって誘発される抗体反応の検出にも使用することができます。 |
| SARS-CoV-2のヌクレオカプシド(N)たんぱく質を標的とする抗体 | SARS-CoV-2に対する適応免疫反応を示す個人を識別するために補助的に使用でき、最近または過去の感染の有無を評価可能です。自然感染とワクチン接種によって誘発された抗体を区別するために使用することができますが、現在国内で承認されている現在入手可能なSARS-CoV-2ワクチンによって誘発される抗体は検出することができません。 |
| SARS-CoV-2のスパイクたんぱく質を標的とするIgM抗体 | SARS-CoV-2に対する適応免疫反応を示す個人を識別するために補助的に使用でき、IgG抗体検査と組み合わせて使用します。SARS-CoV-2感染後、IgM抗体はIgG抗体とほぼ同時期に産生されます。 |
採取する検体の違い
核酸検出法であるPCR検査では、鼻咽頭ぬぐい液、鼻腔ぬぐい液、または唾液を検体として用います。
SARS-CoV-2は上気道から感染することが多く、感染初期の検査には鼻咽頭ぬぐい液を用いることが標準的で信頼性が高いと考えられています。医療従事者が検体を採取する際には、飛沫への曝露リスクが高いため、徹底した感染予防策が必要です。
唾液や鼻腔ぬぐい液を用いる場合は、被検者自身が検体を採取可能であり、医療従事者への感染リスクを軽減することが可能です。ただし、唾液を用いる際には、飲食やうがい、歯磨き後に採取した唾液ではウイルスの検出に影響する可能性があるため、注意が必要です。また唾液では、発症から10日目以降では、鼻咽頭ぬぐい液と比較し、核酸検出法、抗原検査ともに感度が低下し、偽陰性リスクが高まるため、推奨されていません。
鼻腔ぬぐい液を用いた際の検出感度は鼻咽頭ぬぐい液より低いことが懸念されますが、実用性と医療従事者への感染リスクの面から有用であると考えられています。鼻腔ぬぐいの採取方法に関しては、こちらをご参照ください。
参考:厚生労働省ほか. 新型コロナウイルス感染症(COVID-19)病原体検査の指針 第4版. 2021年6月4日

COVID-19検査の種類と適した使用シーン
検査によって特徴が異なることから、シーンによって推奨される検査方法が異なります。
シーンに合わせて適切な検査方法を用いることが重要です。
■ 使用シーンに応じた検査の種類例
- 発熱などの症状が発生し、医療機関を受診し、新型コロナウイルス感染症の疑いがあるとされた

核酸検出検査
抗原定量検査
抗原定性検査(症状が出てから9日以内)

- 新型コロナウイルス感染症患者の周りにいる濃厚接触者(無症状者を含む)の感染を確認する
- 医療施設等でクラスターが発生、陽性者を調べる必要がある
核酸検出検査
抗原定量検査
抗原定性検査

- リスクが高い施設において、有症状者に対して、迅速に検査を実施する

抗原定性検査

- 限られた環境・作業者で、新型コロナウイルスに感染していないか迅速かつ高感度に検査する

抗原定量検査

- 海外出張の前に陰性証明が必要

核酸検出検査
(国によっては)抗原定量検査・抗原定性検査

- 過去に感染したかどうかを確認する
- ワクチン接種により抗体価が上昇しているかを確認する

抗体検査

H.U.グループのCOVID-19への取り組み
①SARS-CoV-2検査の導入・開発
新型コロナウイルス感染症の危機が日本で顕在化する前の、2020年1月からPCR検査体制の構築および抗原検査開発体制の立ち上げを開始、民間検査企業として日本初のSARS-CoV-2のPCR検査受託サービスを開始しました。また2020年5月には、日本で最初の抗原定性検査の承認を受け、続く2020年6月には抗原定量検査の承認を受けています。抗体検査は、2020年6月より、エスアールエルが受託サービスを開始し、2021年3月より、富士レビオが研究用試薬としての販売を開始しています。
それぞれのシーンに適した最適な検査を届けるため、幅広い検査体制の構築・検査試薬の提供を行っています。特に抗原定量検査であるルミパルス SARS-CoV-2 Agは世界に先駆けて開発に成功した、高感度・高スループットに測定可能な抗原定量検査です。唾液を利用することが可能であり、検体採取から測定まで、医療従事者の感染リスクおよび負担を軽減することが可能です。抗原定量検査は、核酸検出検査に匹敵した検出感度を有し、無症状者の方の検査においても利用可能で、そのスループット性の高さから、スクリーニングに力を発揮します。
検査の種類(当社の提供サービス/製品)

②検査の精度の追求
エスアールエルにおける医療機関からの検査の受託においては、臨床検査に50年以上携わってきた経験を活かし、高い品質基準に基づいた検査を実施しています。更に、安定的な検査の提供が重要と考えており、現在までに数多くのSARS-CoV-2の検査試薬について厳しい評価を行い、性能および供給体制に問題のない試薬を選定、日々の検査を実施しています。また、随時、検査結果をモニタリングすることで、日々の検査精度に問題がないことを確認しています。
富士レビオが開発したエスプライン SARS-CoV-2 Agはウイルス中のヌクレオカプシドたんぱく質に結合する抗体を用い、30分以内に、高感度に検出可能な検査試薬です。同製品に関しては、第三者による他社製品との比較評価の結果が報告されています。抗原検査などの検査方法を比較するには、検体の採取条件(発症日から採取日までの経過時間等)が大きく影響し、また同じ検体を用いた検査法の比較が重要なため、同条件下での評価が重要になります。

東京大学医科学研究所のYamayoshiらの研究1)では、SARS-CoV-2分離株および数種類のCOVID-19患者検体を用いた検討結果から、感染能を有する検体におけるエスプライン SARS-CoV-2 Agの感度は高く、他社製品と比較して劣らないことが示されています。また、Cubas-Atienzarらによる研究
2)では、抗原定性検査19製品の検出感度を比較したところ、培養ウイルスを用いた試験でトップレベルの検出感度を示したことが報告されています。さらに、グローバルな非営利評価機関であるFINDによる調査結果3)からは、臨床検体を用いた評価での感度は78.6%であり、またウイルス量が多い検体(RT-PCR時の陽性と判定された際のサイクル数[Ct値]≦25の検体)を用いた評価での感度は92%であったことが報告されています。これらの値は、同じくFINDで評価されている他社製品と比較しても劣らない結果でした。
一方で、エスプライン
SARS-CoV-2 Agは偽陽性が出ることが報告されています。その中で、一部利用方法が本検査に適していない場合もありました。そこで、富士レビオのHPで詳細に使用方法を動画等で掲載し、またよくある質問等をHPに掲載することで、適切な利用を啓蒙する活動を行っています。(
https://www.fujirebio.co.jp/products/espline/sars-cov-2/index.html )。
参考文献
1) Yamayoshi S, et al. Viruses 2020; 12: 1420.
2) Cubas-Atienzar AI, et al. Scientific Reports volume 11, Article number: 18313 (2021)
3) FIND.https://www.finddx.org/sarscov2-eval-antigen/ Accessed 2021年6月1日
③国内の検査体制の強化
当社グループ企業は、国内の民間検査企業として初めて新型コロナウイルス検査の受託を開始しました。現在に至るまでまさに365日体制で、PCR検査などの核酸検出検査、抗原検査、抗体検査等、ほぼ全ての検査に対する受託体制を日本全国で整備しています。
PCR検査と抗原定量検査においては、それぞれの検査を合わせて、全国で約3万件以上/日の検査受託キャパシティを確保しています。
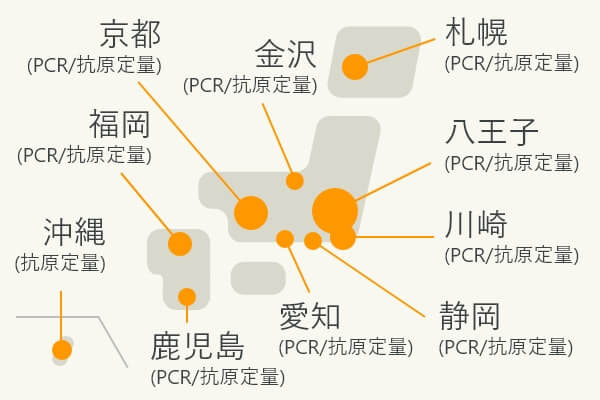 PCR/高感度抗原定量検査 全国検査体制
PCR/高感度抗原定量検査 全国検査体制(八王子ラボを中心に全国検査体制を整備)
また、抗原定量検査試薬は、多様なニーズに適した異なる処理数を有する自動システムが利用可能であり、検査のニーズに応じて大学病院、検査センター、空港検疫などで設置・利用されています。国内空港では8ヵ所の空港で合計50台超の抗原定量検査装置が稼働しています。
抗原定量検査は、抗原の定量値を出すことができる検査方法であり、迅速性を維持しつつ高い精度を誇ります。ただし、無症状者の場合には、陽性的中率が低くなる傾向があります。そのため、第一スクリーニングとして抗原定量検査によりふるいがけし、定量検査の定量値から「判定保留」となった被検者については核酸検出検査を用いることで偽陽性となるリスクを低減可能であることが示されています
4)。そのような二段階検査法を実施することで、迅速かつ正確性が高い検査が可能になると期待されています。実際に空港検疫では、この二段階検査法を用いることで、迅速で安全な水際対策が行われています。
参考文献
4) Yokota I, et al. Lancet Microbe. 2021 May 19. doi: 10.1016/S2666-5247(21)00092-6.
 空港検疫所における検査風景
空港検疫所における検査風景
④変異株への対応と研究
■ 確実な検査に向けて
SARS-CoV-2ウイルスはウイルスの特性上、変異していくことが予想されていました。現在のようにウイルスの増殖や免疫に影響を与える変異株が出現する前から、検査結果に影響を与えうる変異が報告されていました。
核酸検出法では、プライマー結合サイト、プローブ結合サイトに変異が入ることで、検出結果が偽陰性になる可能性があります。そこで、当社では次世代シーケンサーでの配列解析や公的情報等のモニタリングを実施し、生じている変異が受託検査の結果に影響しないかを日々確認してきました。
抗原検査に関しても変異の影響は懸念されます。核酸の変異がアミノ酸変異につながるとは限らないため、抗原検査は、核酸検出検査よりも、変異への影響に弱くはありません。しかし、抗体結合部位にアミノ酸変異が生じた場合、偽陰性につながる可能性があります。そこで、抗原定性検査試薬であるエスプライン SARS-CoV-2 Agおよび抗原定量検査試薬であるルミパルス SARS-CoV-2 Agでは、異なる領域に結合する抗体を複数組み合わせて設計することで、偽陰性となるリスクを低減可能であると考えています。加えて、核酸検出検査と同様に、抗体が結合する部位の変異の有無や、また生じた変異が抗体の結合に影響を与える可能性についても、日々確認しています。実際に空港検疫では、海外から持ち込まれる変異株を検出し、感染者のスムーズな隔離に貢献してきました。既報でも、複数の変異株において抗原検査が問題なく実施可能であることが報告されています
5-9)。
参考文献
5) Kontogianni K, et al. J Infect. 2021; 83: e1-e4.
6) Hirotsu Y, et al. J Infect. 2021; 82: 276-316.
7) Loconsole D, et al. Microbiol Resour Announc. 2021; 10: e01487-21.
8) Loconsole D, et al. Clin Microbiol Infect. 2021 May 10; S1198-743X(21)00228-7.
9) Caputo V, et al. Int J Infect Dis. 2021; 108: 187-189.
⑤顕在化した危機への対応
2020年12月頃より、ウイルスの特性に影響を与える複数の変異株が報告されています。
感染能が高いといわれる変異S:N501Y、S:L452R、ワクチンの効果を減弱させる可能性が指摘されている変異S:E484Kなど、日々異なる変異の出現が報告されています。当社では、変異株を見分けるためのPCR・次世代配列シーケンサーを利用した解析技術を導入し、変異株による感染が市中でどれだけ拡大しているかを把握することにも貢献してきました。また同変異に対しての抗原検査の反応性および反応性に影響を与える変異が出現していないかの確認も実施しています。実際に当社の製品は、現在確認されている各種変異に対する反応性に影響はなく、空港検疫においても海外から持ち込まれる変異株を検出し、感染者の早期隔離に貢献しています。
⑥今後の危機に備えて

新たな変異株は、今後も継続的に発生することが予想されることから、変異のモニタリングと検査技術の改良が大変重要と考えています。
当社では、独自の研究開発を継続し、H.U.グループで提供するPCR検査および抗原検査については、新たな変異株も常に検出することができるように日々確認・改良を加えています。
⑦社会貢献活動
当社グループ企業は、新型コロナウイルスの迅速抗原検査キット「エスプライン®SARS-CoV-2」を2020年9月にネパールに、2021年5月にパキスタンに寄付しました。また、同年7月には、大学等の教育機関において感染拡大防止に同キットを活用いただく目的で、同キットを文部科学省に無償提供しました。
H.U.グループは、上記のような取り組みを通じても、グループ一丸となって新型コロナウイルス感染症の拡大防止に取り組んでいます。
新型コロナウイルス感染症検査のQ&A
A
PCR検査に代表される核酸検出法は、高感度な検査方法です。ただし、専用の機器等が必要のため、特別な検査室で行われることが多い検査になります。試薬ごとの性能差も大きいことが報告されており、試薬によっては反応を阻害する物質等も異なり、増幅物の汚染リスク等もあることから、正しい値を得るためには精度管理が重要となり、測定施設ごとの性能差が大きくなる検査です。また治癒後においても、感染能を有していないウイルスを検出してしまう場合が報告されております。
抗原検査には、高感度な抗原定量検査と簡便かつ迅速な抗原定性検査の2種類があり、抗原定量検査は、感染能が低いことが多いウイルス量が少ない場合を除き、PCR検査と同等の検出精度があり、30分程度と短時間で結果が得られ、COVID-19の確定診断に用いることが可能です。また核酸検出法と同様に有症状者・無症状者を問わずスクリーニングが可能です。また全自動測定機器を用いることで大量の逐次処理が出来るため、短時間で多くの検査とその結果報告が必要な空港検疫や患者数の多い医療機関などで活用されています。一方、抗原定性検査は、特殊な手技や機器を必要としない場合が多く、15~30分程度でその場で結果が得られる検査で、臨床検査の専門家が少ないクリニック、一刻を争う救急医療の現場、さらに感染拡大地域の医療機関、高齢者施設では症状のない人を検査する際にも役立ちます。
それぞれ特徴が異なることから、シーンごとに最適な検査が用いられます。
どちらの検査においても、感染初期においては、検出するのに十分量のウイルスが増えていないため、偽陰性になることが考えられます。そのため、疑わしい場合は、頻度高く検査を実施することが必要です。
その作業性の手軽さから、頻度高い検査に向いている抗原検査を用いることで、感染初期を見逃すリスクの低減も可能であると考えられます。一方でPCR検査を頻度高く実施する場合には、コンタミネーションのリスクが増加するため、自動化等が重要になります。
A
感染していても、ウイルス量が十分でない場合や検体採取が適切に実施されなかった場合など検出できない場合があります。特に唾液検査は、喫煙、飲食やマウスウォッシュで影響をうけると考えられ、検体採取前の30分間は、喫煙、飲食、歯磨きなどは避けていただく必要があります。またPCR検査では様々な阻害物質が知られており、検体によってはウイルスが検出できなくなることが知られております。
A
H.U.グループが提供している検査は、PCRおよび抗原検査(抗原定性検査、抗原定量検査)、抗体検査がございます。
PCR検査においては、体外診断用医薬品の中から、社内で検討を実施し、実検体を用いた測定において十分な性能を発揮する試薬を選択し、利用しております。PCR検査は、販売されている試薬によって、検査の性能が大きく異なることが報告されています。試薬のマニュアルに記載されている性能が発揮されない場合があることも確認しており、日々の検査の精度管理も徹底しております。また、ウイルスに発生する遺伝子変異のモニタリングも実施しており、当社で利用しているプライマー、プローブが認識する配列に変異が生じていないかどうかの確認も実施しております。
抗原検査においては、第三者評価結果が論文として発表されております。抗原定性検査(エスプライン SARS-CoV-2 Ag)においては、SARS-CoV-2分離株および数種類のCOVID-19患者検体を用いた検討結果からは感染能を有する検体における抗原定性検査の感度が高いこと、抗原定性検査19製品の検出感度の比較では培養ウイルスを用いた試験でトップレベルの検出感度を示したこと、臨床検体を用いた評価での感度は78.6%、ウイルス量が多い検体(Ct値≦25)を用いた評価での感度は92%であったことなどが報告されております。
抗原定量検査(ルミパルス SARS-CoV-2 Ag)は、抗原定性検査よりも、さらに感度を高めた検査になります。他社の抗原定量検査との比較論文も出ておりますが、劣っていないことが示されております。また現時点では、唾液を用いた抗原検査を行う事が承認されている唯一の検査であり、検体採取における医療関係者の感染リスクを低減することで、医療現場の負担軽減につながる事が期待されます。
抗体検査も販売を開始しており、初期の感染を見分けるIgMの検査、ワクチンの効果を判定するスパイクタンパク質のIgGの検査等が利用できます。いずれも研究用試薬として提供しております。
抗原定性検査に関して、もっと詳しく知りたい場合には、富士レビオのHPをご覧ください。
https://www.fujirebio.co.jp/products/
espline/sars-cov-2/index.html
A
PCR検査では、変異の入りにくい遺伝子をターゲットとして測定しています。また、複数領域を増幅のターゲットとし、変異の影響を極力受けにくくすることで、変異株に対しても検出可能と考えております。
抗原検査においても、現在変異が問題となっているウイルスが細胞に感染する際に重要なスパイクタンパク質ではなく、ヌクレオカプシドタンパク質を検出する臨床検査薬であり、変異の少ない領域に結合する抗体を複数用いております。また感染拡大している、懸念される変異株(VOC)のヌクレオカプシドタンパク質に反応することを確認しております。このように、複数の異なる種類の抗体を用いた変異に対して影響がでにくいよう、工夫した設計となっておりますが、日々変異の動向を確認し、新たな注目すべき変異が生じた場合には、検証を行い、反応性を確認する対応を行っております。
A
Ct 値とは、PCR検査において検出対象遺伝子の増幅シグナルが陽性と判定された時点の増幅サイクル数のことをいいます。Ct値は検体中のウイルス量に反比例するため、PCR検査の結果、Ct値が低い場合は分析に供されたサンプル中に対象となるRNAが多量に存在したこと、反対にCt値が高い場合は、RNAが少量であったことを示唆します。「Ct値が高い(サンプル中のRNAが少量)から患者の感染性が低い・微陽性」などの表現も見かけますが、Ct値は検体の採取から前処理、分析方法、手技、試薬と装置の組み合わせなど検査工程全般で大きく変動し得る値であり、Ct値の解釈には注意が必要と考えられます。実際、米国臨床化学会(AACC)は、 「Ct値は様々な要因により容易に変動する値であり、患者のマネジメントを目的としてCt値を報告することを控えるべきである」とのレターを公表しております。国内で現時点(2021年7月12日現在)にて承認されているPCR試薬は、全て「定性」検査であり、定量的な利用を目的として設計されていないことにも注意が必要です。また、PCR検査と同様に遺伝子検査法に分類されるLAMP法やTMA法では、測定原理的にCt値は取得できません。Ct値は、試薬や測定機器により異なるため、標準化されていないことにも注意が必要です。
当社製品に関連する主な文献
検査の対象者から見る検査の種類
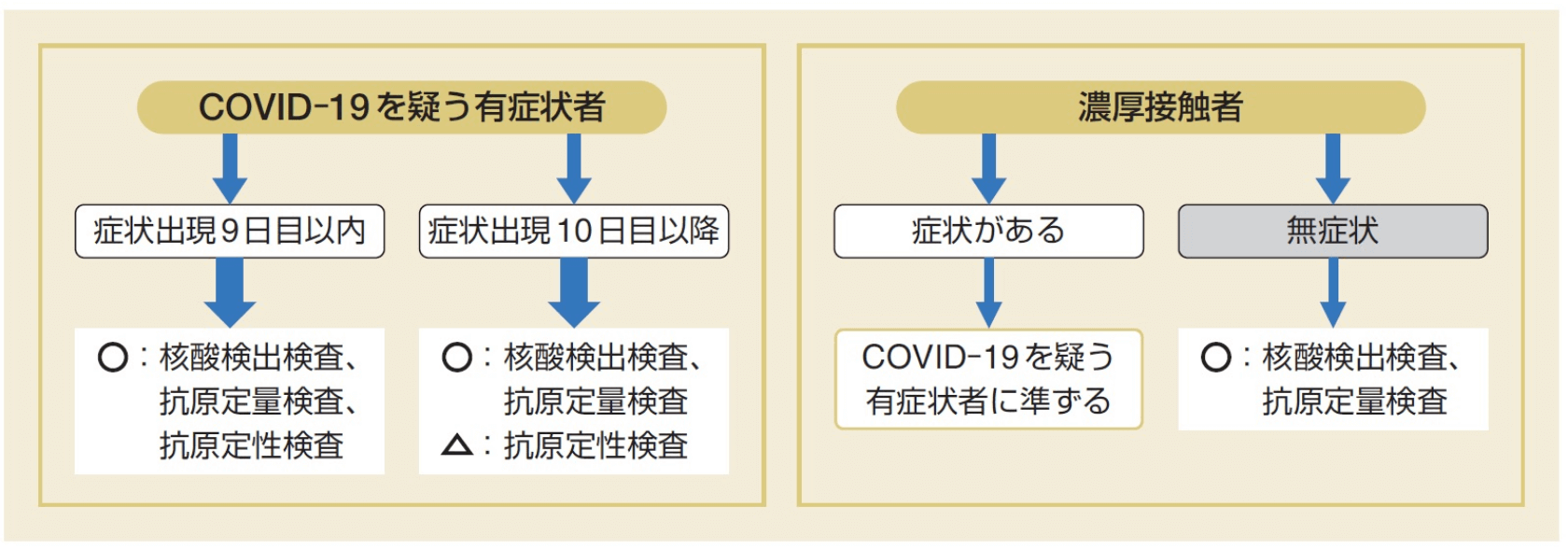
厚生労働省ほか 新型コロナウイルス感染症(COVID-19)病原体検査の指針 第4版より
各検査の測定対象
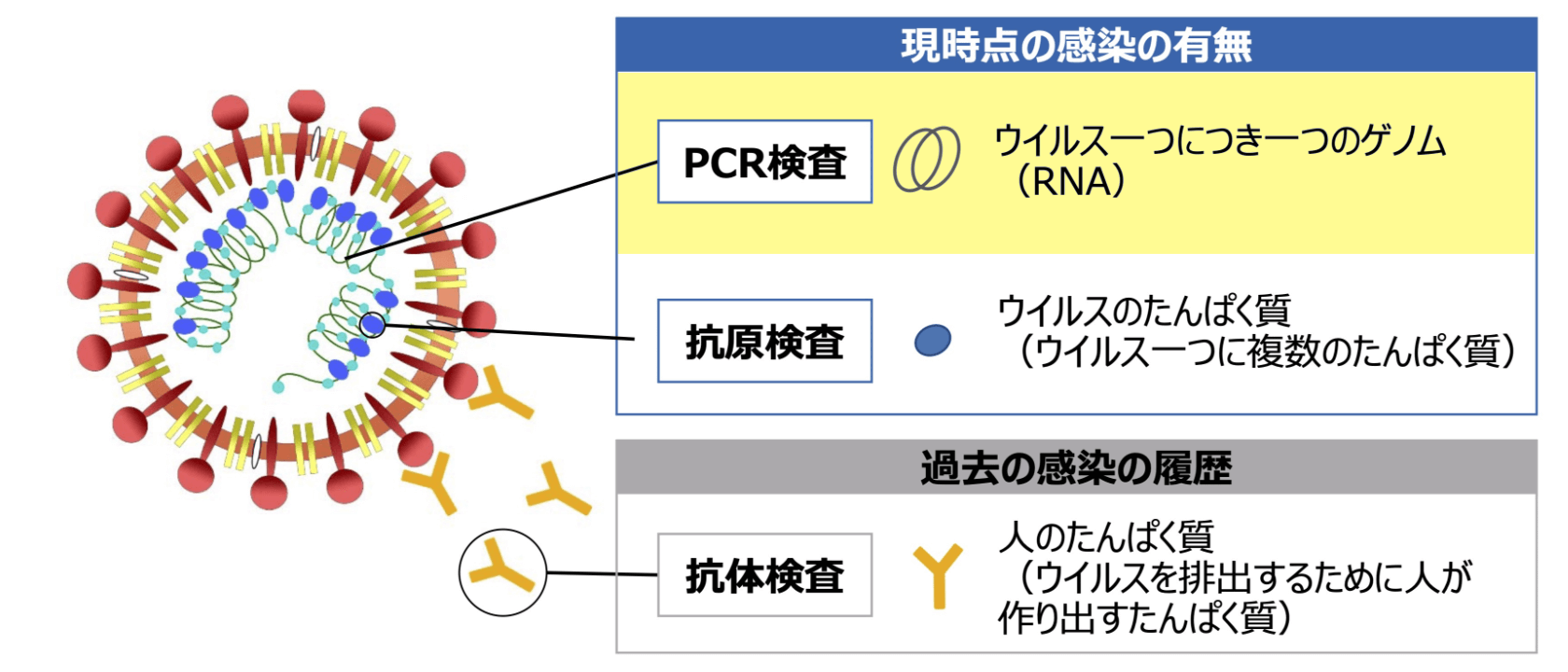
各検査の測定対象
各検査の測定対象